Аллергия на пыльцу амброзии является одной из самых распространённых форм сезонной аллергии (поллиноза), охватывающей миллионы людей по всему миру. Симптомы включают насморк, зуд в носу и глазах, чихание, одышку и даже бронхиальную астму. Несмотря на широкое применение антигистаминных препаратов и иммунотерапии, уровень заболеваемости продолжает расти, особенно среди детей и городского населения.
Современные научные исследования всё чаще указывают на то, что состояние кишечного микробиома играет ключевую роль в развитии и модуляции аллергических реакций, включая поллиноз. Нарушения микробного состава кишечника – дисбиоз – ассоциированы с нарушениями иммунной толерантности, гиперактивностью иммунной системы и повышенной проницаемостью кишечной стенки, что способствует сенсибилизации к аллергенам.
Амброзия (Ambrosia artemisiifolia) – инвазивное растение из семейства астровых, пыльца которого является сильным аллергеном. Один куст способен продуцировать до миллиарда пыльцевых зёрен за сезон. Распространение амброзии значительно увеличилось за последние десятилетия из-за глобального потепления и урбанизации.
Иммунологические механизмы развити аллергии на амброзию
Аллергия на амброзию является IgE-опосредованной реакцией гиперчувствительности. При первом контакте с аллергеном происходит сенсибилизация – организм вырабатывает специфические IgE-антитела. При последующих контактах с аллергеном происходит его связывание с антителами на поверхности тучных клеток, что вызывает их дегрануляцию и выброс гистамина, лейкотриенов и других медиаторов воспаления.
Влияние микробиома кишечника на развитие аллергии на амброзию
Микробиом кишечника – это совокупность триллионов микроорганизмов, включая бактерии, археи, вирусы и грибы, проживающих в желудочно-кишечном тракте. Доминирующими типами бактерий являются Firmicutes, Bacteroidetes, Actinobacteria и Proteobacteria.
Микробиота выполняет множество жизненно важных функций:
- образование короткоцепочечных жирных кислот (масляная, уксусная, пропионовая), модулирующих иммунную активность
- обучение и регуляция иммунной системы
- поддержание барьерной функции кишечника
- метаболизм лекарств и ксенобиотиков
- вытеснение патогенной микрофлоры
Образование короткоцепочечных жирных кислот (КЖК)
Микроорганизмы в толстом кишечнике ферментируют неперевариваемые пищевые волокна, вырабатывая короткоцепочечные жирные кислоты: ацетат, пропионат и бутират (масляная кислота).
Эти соединения выполняют ряд важных задач:
- бутират – основной источник энергии для эпителиальных клеток толстой кишки, поддерживает их жизнеспособность и предотвращает воспаление
- пропионат – влияет на печеночный глюконеогенез и может снижать уровень холестерина
- ацетат – участвует в липогенезе и может проникать в системный кровоток, влияя на энергетический обмен
- все короткоцепочечных жирных кислот обладают противовоспалительным эффектом и модулируют иммунные реакции, снижая риск аутоиммунных заболеваний и аллергий
Обучение и регуляция иммунной системы
- микробиота способствует созреванию иммунной системы у новорождённых и поддерживает её в активном состоянии у взрослых
- через взаимодействие с клетками иммунной системы (например, дендритными клетками и лимфоцитами), микробиота обучает организм различать “своё” и “чужое”, снижая вероятность аутоиммунных реакций
- продукты жизнедеятельности бактерий могут активировать рецепторы Toll-подобных рецепторов (TLR) на клетках иммунной системы, что влияет на продукцию цитокинов и запуск воспалительных каскадов
Поддержание барьерной функции кишечника
- микробиом способствует укреплению плотных контактов (tight junctions) между эпителиальными клетками кишечника, предотвращая проникновение токсинов и патогенов в кровь
- стимулирует продукцию слизи (муцина), которая защищает эпителий от механических и химических повреждений
- некоторые бактерии стимулируют выработку секреторного иммуноглобулина A (sIgA), укрепляющего местный иммунитет
Метаболизм лекарств и ксенобиотиков
- микроорганизмы кишечника обладают ферментативной активностью, способной активировать, инактивировать или токсично модифицировать различные лекарственные препараты и химические соединения
- например, микробиота участвует в дегидроксилировании, глюкуронизации, сульфатировании и гидролизе веществ
- это может усиливать или ослаблять действие лекарств, вызывать побочные эффекты или влиять на их биодоступность
Вытеснение патогенной микрофлоры (колонизационная резистентность)
- микробиота занимает питательные ниши и рецепторы на эпителии, конкурируя с патогенами за ресурсы и места прикрепления
- продуцирует бактериоцидные вещества (например, бактериоцины), подавляющие рост патогенов
- создаёт неблагоприятные условия для патогенов – например, за счёт подкисления среды КЖК
- силивает иммунный ответ на патогены, включая активацию макрофагов и усиление продукции антител
Связь между микробиомом и иммунной системой
- Роль в развитии иммунной толерантности. На ранних этапах жизни микробиом «обучает» иммунную систему распознавать «своё» и «чужое». Присутствие симбиотических бактерий способствует развитию регуляторных Т-клеток (Treg), которые подавляют гиперреактивные ответы. Их дефицит может способствовать развитию аллергий.
- Микробиом и Th2-ответ. Аллергические реакции опосредованы преобладанием Th2-клеточного ответа. При дисбиозе усиливается экспрессия Th2-цитокинов (IL-4, IL-5, IL-13), что приводит к увеличенной продукции IgE. Здоровая микрофлора способствует балансировке Th1/Th2 и увеличению популяции Treg-клеток.
Нарушения микробиома и развитие аллергии на амброзию
Факторы, способствующие нарушению микробиома
- роды путем кесарева сечения
- искусственное вскармливание
- частое применение антибиотиков
- диеты с низким содержанием клетчатки
- стресс, плохая экология
Исследования связи микробиома и поллиноза
Метаанализы последних лет показывают, что у пациентов с поллинозом наблюдается сниженное разнообразие микрофлоры, особенно снижение уровней Bifidobacterium и Lactobacillus. У таких пациентов также увеличено содержание Proteobacteria, ассоциированных с воспалением.
В одном исследовании, проведённом в Германии, выявлено, что дети с аллергией на амброзию имеют более высокий уровень кишечной проницаемости и повышенное содержание липополисахаридов в крови, что указывает на системное воспаление.
Потенциал коррекции микробиома в терапии аллергии
- Пребиотики и диета. Рацион с высоким содержанием клетчатки (инулин, пектины, резистентный крахмал) способствует росту полезной микрофлоры, особенно продуцентов короткоцепочечных жирных кислот, которые способствуют регуляции иммунной функции.
Диета с растительным уклоном и низким содержанием сахара уменьшает воспалительные реакции.
- Пробиотики. Наиболее изученные пробиотики в контексте аллергий – Lactobacillus rhamnosus GG, Lactobacillus casei, Bifidobacterium longum. Их применение снижает симптомы аллергического ринита, уменьшает выработку IgE и усиливает иммунную толерантность.
Исследование в Японии показало, что при приёме Bifidobacterium breve у пациентов с аллергией на амброзию отмечено снижение симптомов на 30% по сравнению с плацебо.
- Фекальная микробиотная трансплантация (FMT) пока изучается в основном при заболеваниях ЖКТ (например, Clostridium difficile), но первые работы показывают её потенциал при системных иммунных заболеваниях, включая аллергии. Однако этот метод требует более строгих стандартов безопасности и доказательств эффективности.
- Постбиотики –метаболиты микробов, в том числе короткоцепочечные жирные кислоты (SCFA), полисахариды и другие молекулы — потенциально способны оказывать терапевтическое действие без риска введения живых бактерий. Масляная кислота, например, укрепляет барьер кишечника и стимулирует развитие Treg-клеток.
Кишечник как регулятор системной аллергической реакции
- Повышенная проницаемость кишечника (синдром «дырявого кишечника») позволяет частицам пищи, бактериальным продуктам и аллергенам проникать в кровоток, провоцируя системную сенсибилизацию. Это усиливает склонность к аллергии на внешние раздражители, включая пыльцу амброзии.
- Микробиом и кожные реакции. При аллергии на амброзию часто возникают не только респираторные, но и кожные симптомы- экзема, зуд. Состояние микробиоты кишечника влияет на кожный иммунитет- так называемая «ось кишечник-кожа». Улучшение микробного состава способствует ремиссии кожных проявлений аллергии.
Персонализированная терапия: микробиом и иммуномодуляция
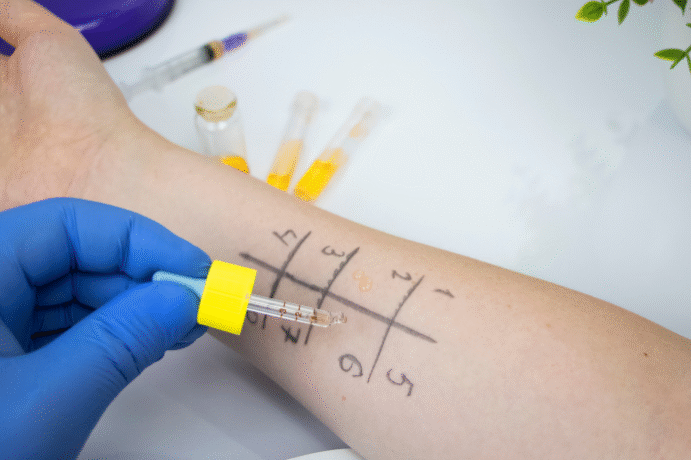
- Анализ микробиома как диагностический инструмент. Современные методы (16S рРНК-секвенирование, метагеномика) позволяют определять состав микрофлоры и выявлять дисбаланс, предрасполагающий к аллергиям. Это открывает путь к персонализированной коррекции диеты, назначения пробиотиков и других интервенций.
- Иммунотерапия и микробиота. Субъективная эффективность аллерген-специфической иммунотерапии (АСИТ) зависит от состояния кишечной флоры. Пациенты с более сбалансированной микробиотой демонстрируют более выраженное снижение чувствительности к аллергену.
Ранняя профилактика аллергии через микробиом
- Микробиота матери. Микробиом матери во время беременности и лактации формирует микрофлору ребёнка. Установлено, что дети, рождённые от матерей с дисбиозом, имеют более высокий риск развития аллергий, включая поллиноз.
- Пробиотики у беременных и младенцев. Профилактический приём пробиотиков во время беременности и в младенческом возрасте снижает риск развития аллергических состояний. Особенно эффективны штаммы Lactobacillus rhamnosus GG и Bifidobacterium lactis.
Коррекця микробиоты кишечника при лечении алергии на амброзию
- проведение анализа микробиоты у аллергиков поможет в подборе терапии
- включение в рацион пребиотиков и увеличение потребления клетчатки нормализует микробиом
- коррекция микробиоты – часть комплексной терапии наряду с медикаментозной терапией, методами детоксикации организма, озонотерапией, висцеральной терапией
- Висцеральная терапия – мягкое мануальное воздействие на органы живота через переднюю брюшную стенку.
- улучшает кровообращение и лимфоток, восстанавливает работу пищеварительной системы, устраняет застой в печени, кишечнике, поджелудочной железе
- способствует нормализации перистальтики, выведению аллергенных комплексов, снятию спазмов и уменьшению общего воспалительного фона
- поддерживает гармонию между органами пищеварения и иммунной системой, что важно при аллергических заболеваниях
- внутривенное введение озонированного физраствора, проведение большой аутогемоозонотерапии активирует иммунную систему, снижает чувствительность к аллергенам, выводит токсины
- ректальные инсуффляции озоно-кислородной смесьювоздействуют на микробиоту кишечника, восстанавливают её баланс, улучшают всасывание полезных веществ
- санация Лор-органов озоно-кислородной смесью
- озонированные масла и вода – применяются как внутрь, так и наружно (при кожных проявлениях аллергии), обладают выраженным противовоспалительным, антисептическим и иммуномодулирующим эффектом
- методы озонотерапии помогают снизить гистаминовую активность, уменьшить отёк слизистых и проявления ринита
Аллергия на амброзию – сложное, мультифакторное заболевание, при котором кишечный микробиом играет ключевую роль в патогенезе и может быть мишенью для терапии. Сбалансированная микрофлора способствует развитию иммунной толерантности, снижает выраженность аллергических реакций и усиливает эффективность традиционных методов лечения.
Модуляция микробиоты с помощью детоксикации организма, методов озонотерапии, пробиотиков, пребиотиков, постбиотиков, а также с помощью персонализированной диеты и, возможно, трансплантации микробиоты в будущем, открывает новые горизонты в профилактике и лечении аллергии на амброзию.




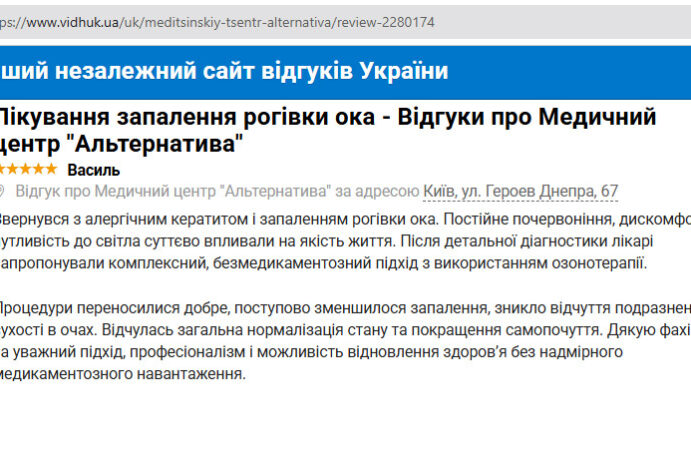


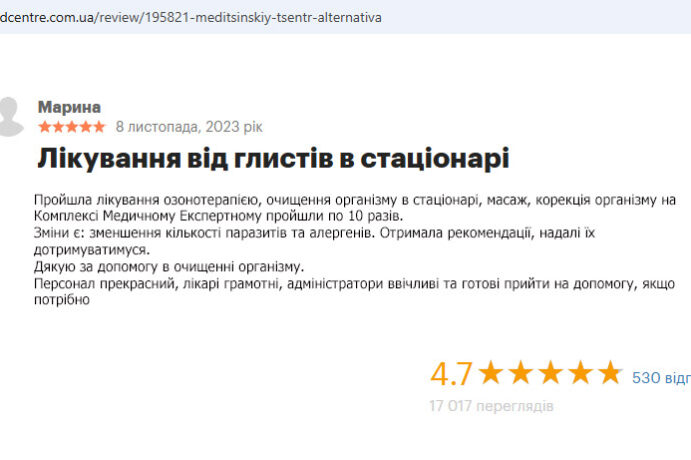

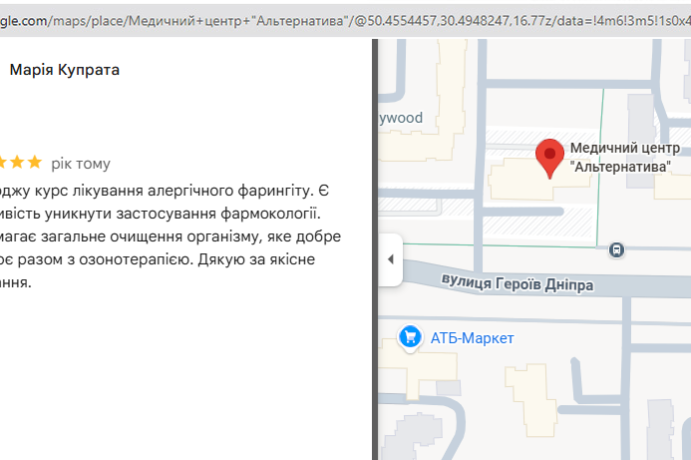

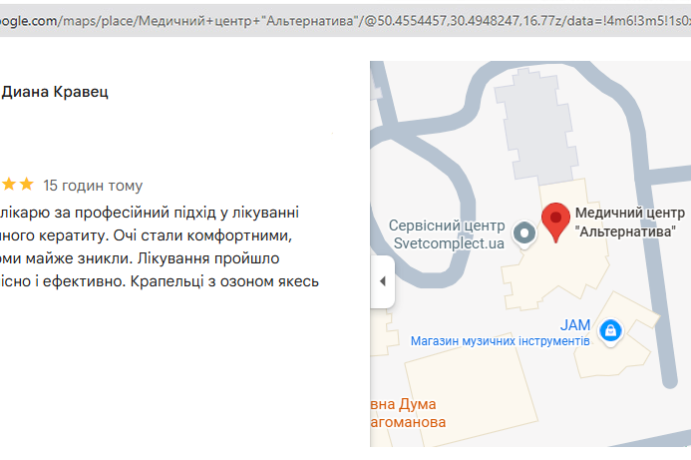



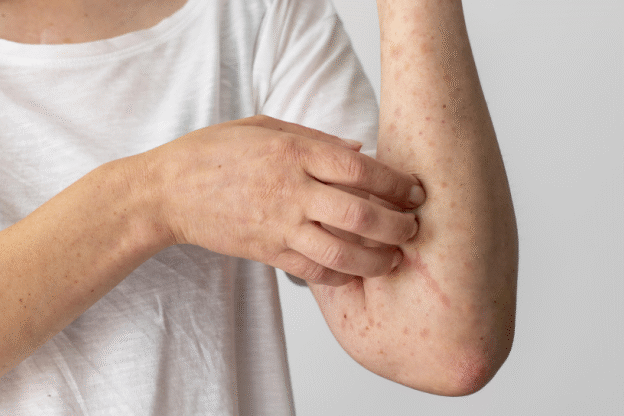













Лето перестало быть кошмаром. Обратилась в Альтернативу по совету подруги. Сделали анализ микробиоты, начали работу с пищеварительной системой и кожа стала чище, нос свободный. Теперь просто живу нормально.