Алергія на пилок амброзії є однією з найпоширеніших форм сезонної алергії (полінозу). Симптоми включають нежить, свербіж у носі та очах, чхання, задишку і навіть бронхіальну астму. Незважаючи на широке застосування антигістамінних препаратів та імунотерапії, рівень захворюваності продовжує зростати, особливо серед дітей та міського населення.
Сучасні наукові дослідження все частіше вказують на те, що стан кишкового мікробіома відіграє ключову роль у розвитку та модуляції алергічних реакцій, включаючи поліноз. Порушення мікробного складу кишківника – дисбіоз – асоційовані з порушеннями імунної толерантності, гіперактивністю імунної системи та підвищеною проникністю кишкової стінки, що сприяє сенсибілізації до алергенів.
Амброзія (Ambrosia artemisiifolia) – інвазивна рослина із сімейства айстрових, пилок якого є сильним алергеном. Один кущ здатний продукувати до мільярда пилкових зерен за сезон. Поширення амброзії значно збільшилося за останні десятиліття через глобальне потепління та урбанізацію.
Імунологічні механізми розвитку алергії на амброзію
Алергія на амброзію є IgE-опосередкованою реакцією гіперчутливості. При першому контакті з алергеном відбувається сенсибілізація – організм виробляє специфічні IgE-антитіла. При наступних контактах з алергеном відбувається його зв’язування з антитілами на поверхні опасистих клітин, що спричиняє їх дегрануляцію та викид гістаміну, лейкотрієнів та інших медіаторів запалення.
Вплив мікробіома кишківника на розвиток алергії на амброзію
Мікробіом кишківника – це сукупність трильйонів мікроорганізмів, включаючи бактерії, археї, віруси та гриби, які проживають у шлунково-кишковому тракті. Домінуючими типами бактерій є Firmicutes, Bacteroidetes, Actinobacteria та Proteobacteria.
Мікробіота виконує безліч життєво важливих функцій:
- утворення коротколанцюгових жирних кислот (олійна, оцтова, пропіонова), що модулюють імунну активність
- навчання та регулювання імунної системи
- підтримання бар’єрної функції кишківника
- метаболізм ліків та ксенобіотиків
- витіснення патогенної мікрофлори
Утворення коротколанцюгових жирних кислот
Мікроорганізми в товстому кишківнику ферментують неперетравлювані харчові волокна, виробляючи коротколанцюгові жирні кислоти: ацета, пропіонат і бутират (масляна кислота).
Ці сполуки виконують низку важливих завдань:
- бутират – основне джерело енергії для епітеліальних клітин товстої кишки, підтримує їх життєздатність та запобігає запаленню
- пропіонат – впливає на печінковий глюконеогенез та може знижувати рівень холестерину.
- ацетат – бере участь у ліпогенезі та може проникати у системний кровотік, впливаючи на енергетичний обмін
- всі коротколанцюгових жирних кислоти мають протизапальний ефект і модулюють імунні реакції, знижуючи ризик аутоімунних захворювань та алергій
Навчання та регулювання імунної системи
- мікробіота сприяє дозріванню імунної системи у новонароджених та підтримує її в активному стані у дорослих
- через взаємодію з клітинами імунної системи (наприклад, дендритними клітинами та лімфоцитами), мікробіота навчає організм розрізняти “своє” та “чуже”, знижуючи ймовірність аутоімунних реакцій
- продукти життєдіяльності бактерій можуть активувати рецептори Toll-подібних рецепторів (TLR) на клітинах імунної системи, що впливає на продукцію цитокінів та запуск запальних каскадів.
Підтримка бар’єрної функції кишківника
- мікробіом сприяє зміцненню щільних контактів (tight junctions) між епітеліальними клітинами кишківника, запобігаючи проникненню токсинів та патогенів у кров.
- стимулює продукцію слизу (муцину), яка захищає епітелій від механічних та хімічних ушкоджень.
- деякі бактерії стимулюють вироблення секреторного імуноглобуліну A (sIgA), що зміцнює місцевий імунітет
Метаболізм ліків та ксенобіотиків
- мікроорганізми кишківника мають ферментативну активність, здатну активувати, інактивувати або токсично модифікувати різні лікарські препарати та хімічні сполуки
- наприклад, мікробіота бере участь у дегідроксилуванні, глюкуронізації, сульфатуванні та гідролізі речовин
- це може посилювати або послаблювати дію ліків , викликати побічні ефекти або впливати на їх біодоступність.
Витіснення патогенної мікрофлори (колонізаційна резистентність)
- мікробіота займає живильні ніші та рецептори на епітелії, конкуруючи з патогенами за ресурси та місця прикріплення
- продукує бактеріоцидні речовини (наприклад, бактеріоцини), що пригнічують зростання патогенів
- створює несприятливі умови для патогенів – наприклад, рахунок підкислення середовища КЖК
- посилює імунну відповідь на патогени, включаючи активацію макрофагів та посилення продукції антитіл
Зв’язок між мікробіомом та імунною системою
- Роль у розвитку імунної толерантності. На ранніх етапах життя мікробіом «навчає» імунну систему розпізнавати «своє» та «чуже». Присутність симбіотичних бактерій сприяє розвитку регуляторних Т-клітин (Treg), які пригнічують гіперреактивні відповіді. Їхній дефіцит може сприяти розвитку алергій.
- Мікробіом та Th2-відповідь. Алергічні реакції опосередковані перевагою Th2-клітинної відповіді. При дисбіозі посилюється експресія Th2-цитокінів (IL-4, IL-5, IL-13), що призводить до збільшення продукції IgE. Здорова мікрофлора сприяє балансуванню Th1/Th2 та збільшенню популяції Treg-клітин.
Порушення мікробіома та розвиток алергії на амброзію
Чинники, які сприяють порушенню мікробіома
- пологи шляхом кесаревого розтину
- штучне вигодовування
- часте застосування антибіотиків
- дієти з низьким вмістом клітковини
- стрес, погана екологія
Дослідження зв’язку мікробіома та полінозу
Метааналізи останніх років показують, що у пацієнтів з полінозом спостерігається знижена різноманітність мікрофлори, особливо зниження рівнів Bifidobacterium та Lactobacillus. У таких пацієнтів також збільшено вміст Proteobacteria, асоційованих із запаленням.
В одному дослідженні, проведеному в Німеччині, виявлено, що діти з алергією на амброзію мають більш високий рівень кишкової проникності та підвищений вміст ліпополісахаридів у крові, що вказує на системне запалення.
Потенціал корекції мікробіома у терапії алергії
- Пребіотики та дієта. Раціон з високим вмістом клітковини (інулін, пектини, резистентний крохмаль) сприяє зростанню корисної мікрофлори, особливо продуцентів коротколанцюгових жирних кислот, які сприяють регуляції імунної функції.
Дієта з рослинним ухилом та низьким вмістом цукру зменшує запальні реакції.
- Пробіотики. Найбільш вивчені пробіотики в контексті алергій – Lactobacillus rhamnosus GG, Lactobacillus casei, Bifidobacterium longum. Їх застосування знижує симптоми алергічного риніту, зменшує вироблення IgE та посилює імунну толерантність.
Дослідження у Японії показало, що з прийомі Bifidobacterium breve у пацієнтів з алергією на амброзію відмічено зниження симптомів на 30% проти плацебо.
- Фекальна мікробіотна трансплантація (FMT) поки що вивчається в основному при захворюваннях шлунково-кишкового тракту (наприклад, Clostridium difficile), але перші роботи показують її потенціал при системних імунних захворюваннях, включаючи алергії. Однак цей метод потребує суворіших стандартів безпеки та доказів ефективності.
- Постбіотики – метаболіти мікробів, у тому числі коротколанцюгові жирні кислоти (SCFA), полісахариди та інші молекули – потенційно здатні надавати терапевтичну дію без ризику введення живих бактерій. Масляна кислота, наприклад, зміцнює бар’єр кишківника та стимулює розвиток Treg-клітин.
Кишківник як регулятор системної алергічної реакції
- Підвищена проникність кишківника (синдром «дірявого кишківника») дозволяє частинкам їжі, бактеріальним продуктам та алергенам проникати в кровотік, провокуючи системну сенсибілізацію. Це посилює схильність до алергії на зовнішніх подразників, включаючи пилок амброзії.
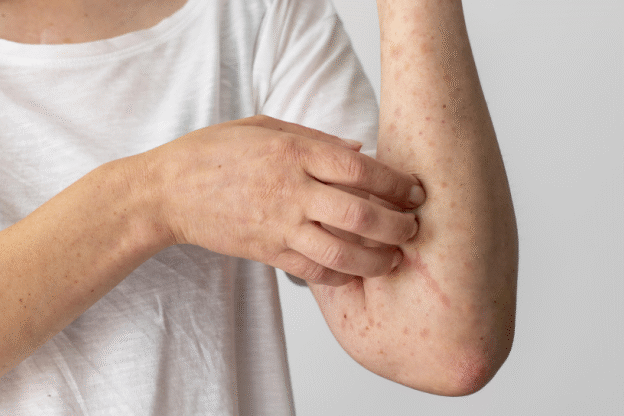
- Мікробіом і шкірні реакції. При алергії на амброзію часто виникають не тільки респіраторні, а й шкірні симптоми-екзема, свербіж. Стан мікробіоти кишківника впливає на шкірний імунітет-так звана «вісь кишківник-шкіра». Поліпшення мікробного складу сприяє ремісії шкірних проявів алергії.
Персоналізована терапія: мікробіом та імуномодуляція
- Аналіз мікробіоми як діагностичний інструмент. Сучасні методи (16S рРНК-секвенування, метагеноміка) дозволяють визначати склад мікрофлори та виявляти дисбаланс, що привертає до алергій. Це відкриває шлях до персоналізованої корекції дієти, призначення пробіотиків та інших інтервенцій.
- Імунотерапія та мікробіота. Суб’єктивна ефективність алерген-специфічної імунотерапії (АСІТ) залежить від стану кишкової флори. Пацієнти з більш збалансованою мікробіотою демонструють більш виражене зниження чутливості до алергену.
Рання профілактика алергії через мікробіом
- Мікробіота матері. Мікробіом матері під час вагітності та лактації формує мікрофлору дитини. Встановлено, що діти, народжені від матері з дисбіозом, мають більш високий ризик розвитку алергій, включаючи поліноз.
- Пробіотики у вагітних та немовлят . Профілактичний прийом пробіотиків під час вагітності та у дитячому віці знижує ризик розвитку алергічних станів. Особливо ефективні штами Lactobacillus rhamnosus GG та Bifidobacterium lactis.
Корекція мікробіоти кишківника при лікуванні алергії на амброзію
- проведення аналізу мікробіоти у алергіків допоможе у підборі терапії
- включення до раціону пребіотиків та збільшення споживання клітковини нормалізує мікробіом
- корекція мікробіоти – частина комплексної терапії поряд з медикаментозною терапією, методами детоксикації організму, озонотерапією, вісцеральною терапією
- Вісцеральна терапія – м’яка мануальна дія на органи живота через передню черевну стінку
- покращує кровообіг і лімфоток , відновлює роботу травної системи , усуває застій у печінці, кишківнику, підшлунковій залозі
- сприяє нормалізації перистальтики, виведенню алергенних комплексів, зняттю спазмів та зменшенню загального запального фону
- підтримує гармонію між органами травлення та імунною системою, що важливо при алергічних захворюваннях.
- внутрішньовенне введення озонованого фізрозчину, проведення великої аутогемоозонотерапії активує імунну систему, знижує чутливість до алергенів, виводить токсини
- ректальні інсуффляції озоно-кисневою сумішшю впливають на мікробіоту кишківника, відновлюють її баланс, покращують всмоктування корисних речовин
- санація Лор-органів озоно-кисневою сумішшю
- озоновані масла і вода – застосовуються як всередину, так і зовнішньо (при шкірних проявах алергії), мають виражений протизапальний, антисептичний та імуномодулюючий ефект
- методи озонотерапії допомагають знизити гістамінову активність, зменшити набряк слизових та прояви риніту.
Алергія на амброзію – складне, мультифакторне захворювання, при якому кишковий мікробіом відіграє ключову роль у патогенезі та може бути мішенню для терапії. Збалансована мікрофлора сприяє розвитку імунної толерантності, знижує вираженість алергічних реакцій та посилює ефективність традиційних методів лікування.
Модуляція мікробіоти за допомогою детоксикації організму, методів озонотерапії, пробіотиків, пребіотиків, постбіотиків, а також за допомогою персоналізованої дієти та, можливо, трансплантації мікробіоти в майбутньому, відкриває нові горизонти у профілактиці та лікуванні алергії на амброзію.



























Літо перестало бути жахом. Я звернулась в Альтернативу за порадою подруги. Зробили аналіз мікробіоти, почали працювати зі шлунково кишковим трактом і шкіра стала чистішою, а ніс не закладений. Тепер просто живу нормально.